Технология
Метод NGS позволяет анализировать все хромосомы эмбриона, а также выявлять мозаицизм и несбалансированные хромосомные перестройки
Скрининг эмбрионов при проведении ВРТ для повышения шансов на успешную имплантацию, беременность и рождение ребенка.
ПГТ-А или преимплантационное генетическое тестирование на анеуплоидии — скрининг эмбрионов в цикле вспомогательных репродуктивных технологий на наличие хромосомных аномалий перед переносом в полость матки с целью повышения вероятности достижения успешной беременности.
ПГТ-А ранее был известен как ПГС, преимплантационный генетический скрининг.
20%человеческих яйцеклеток
9%человеческих сперматозоидов
В естественном гаметогенезе, считается, что примерно 20% человеческих яйцеклеток и 9% человеческих сперматозоидов являются анеуплоидными*. Анеуплоидные гаметы, вовлеченные в процесс оплодотворения приводят к развитию анеуплоидных эмбрионов, что зачастую проявляется в виде неудач имплантации или потери беременности.
*Martin RH. Meiotic errors in human oogenesis and spermatogenesis. Reprod BioMed Online 2008;16(4):523-31
38%–76%спонтанных абортов сопровождается выявлением хромосомных аномалий
Согласно данным мировой статистики и российской статистики, распространенность хромосомных аномалий, выявляемых при спонтанном аборте колеблется от 38% до 76%*. Частота анеуплоидий у эмбрионов в циклах ВРТ возрастает с увеличением возраста матери, достигая 80% у пациенток старше 40 лет**.
*Чиряева О. Г. и соавт., 2012, Волков А. Н. и соавт. 2017, Carp H, et al.,2001, Rosa Russo et al., 2016)
**Macklon NS et al. Conception to ongoing pregnancy: the “black box” of early pregnancy loss. Hum Reprod Update 2002;8:333-343
38%–73%эмбрионов в циклах ВРТ содержат анеуплоидные клетки
Недавние крупные исследования эмбрионов человека показали, что 38-73% эмбрионов в циклах ВРТ содержат анеуплоидные клетки. Различия в статистических данных объясняются в основном различным средним значением возраста яйцеклеток
Le Thi Bich Phuong et all. Selecting euploid embryo for transfer by preimplantation genetic testing for aneuploidy improved clinical outcomes in patients with advanced maternal age DOI : 10.15419/bmrat.v6i12.581
X Viñals Gonzalez et all, Euploid Blastocysts Implant Irrespective of Their Morphology After NGS-(PGT-A) Testing in Advanced Maternal Age Patients, 2019.
ПГТ-А становится одним из наиболее ценных инструментов для повышения успеха наступления беременности с помощью вспомогательных репродуктивных технологий. Поскольку показатели мозаицизма можно количественно определять методом NGS, мозаичные эмбрионы по нежизнеспособным хромосомам можно рассматривать для переноса, когда нет доступных эуплоидных эмбрионов.
Увеличением частоты имплантации
В среднем до 50-69%, данные различаются в зависимости от возрастной группы и сопутствующих клинических данных
Simon AL, et al, Pregnancy outcomes from more than 1,800 in vitro fertilization cycles with the use of 24-chromosome single-nucleotide polymorphism-based preimplantation genetic testing for aneuploidy. Fertil Steril. 2018
Снижением частоты неразвивающихся беременностей
В общей популяции 25% всех клинических беременностей заканчиваются выкидышем. Около 50% спорадических ранних выкидышей обусловлено хромосомными дефектами. Риск выкидыша снижается при переносе эуплоидного эмбриона.
Выкидыш в ранние сроки беременности: диагностика и тактика ведения, клинические рекомендации.
Сокращением времени до наступления беременности
Время до наступления беременности с ПГТ-А сокращается с 15 недель до 8 недель.
Rubio et al., In vitro fertilization with preimplantation genetic diagnosis for aneuploidies in advanced maternal age: a randomized, controlled study. Fertil Steril. 2017
Снижением риска осложнений при многоплодной беременности
Высокая частота многоплодных беременностей является следствием переноса нескольких эмбрионов в программах ВРТ. Также многоплодие может быть следствием естественно наступившей беременности. По данным Регистра ВРТ РАРЧ за 2015 год, частота многоплодных родов в программах ЭКО и ИКСИ составила 19,7% от всех родов, после переноса размороженных эмбрионов — 15,2%, в программе «Донорство ооцитов» — 20,4%, в программе суррогатного материнства — 25,2% (91).
С целью профилактики многоплодной беременности рекомендуется селективный перенос 1 эмбриона в полость матки.
ВРТ и искусственная инсеминация, клинические рекомендации
После периода витрификации переносятся эуплоидные эмбрионы, что позволяет выиграть время для проведения скрининга на хромосомные аномалии, а также подготовить эндометрий к имплантации.
Во всех этих группах пациентов предполагается повышенная частота хромосомных аномалий у эмбрионов.
Мозаицизм может существовать в клетках, входящих в состав трофэктодермы. Способность идентифицировать мозаицизм в пределах трофэктодермы представляла значительную сложность, и для преодоления этой проблемы были реализованы следующие подходы:
Современные диагностические технологии тестируют клетки, предназначенные стать плацентой, а не клетки внутренней клеточной массы, которая дифференцируется в плод. Биопсия внутриклеточной массы не рекомендуется из-за опасений относительно дальнейшей дифференцировки плода.
~8000образцов
% Нормы
Рекомендованные к переносу (N+mos)
Изолированные сегментарные нарушения (%)
В таблице представлены результаты клиник по России «overachievers», с которыми отлажено взаимодействие и не возникает сомнений в «правильности» работы «эмбриологического» протокола. «Underachievers» — единичные клиники, у которых были замечены отклонения от привычных данных статистики и предложены решения по аудиту и поиску потенциальных причин нарушений.
На основании данных переноса более 700 эуплоидных эмбрионов, было показано, что негативными предикторами исхода могут быть:
число неудачных исходов беременности
биопсия эмбриона на 6 день (по сравнению с 5 днем)
повышенный индекс массы тела
Fazilet Kubra Boynukalin et al.,Parameters impacting the live birth rate per transfer after frozen single euploid blastocyst transfer, 2020
для чувствительной детекции мозаицизма и сегментарных нарушений всех хромосом
1,5 календарных дня
(по согласованию)
7 календарных дней
12 рабочих дней
на каждом этапе исследования
из любого города России
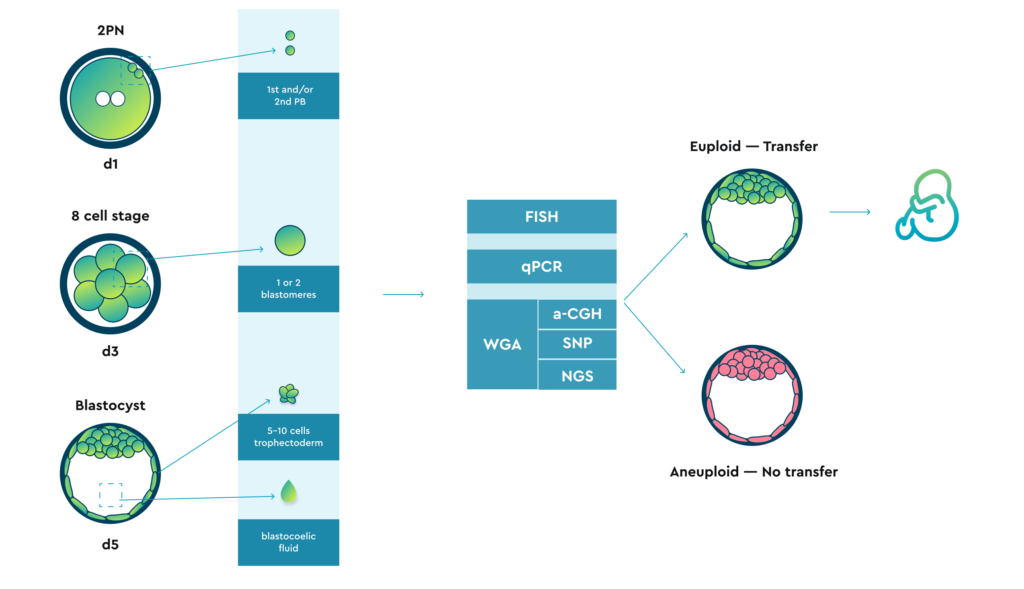
Потенциально биопсия может быть выполнена на трех различных стадиях:
Кроме того, в литературе встречаются данные о попытках аспирировать небольшой объем бластокоэтической жидкости.
Все виды упомянутого ранее биоматериала потенциально могут быть проанализированы с использованием различных технологий. Однако:
Хромосомный анализ используется в клинической практике с середины 90-х годов.
FISH флуоресцентная гибридизация
90-е годы
Первоначально эта диагностическая стратегия была выполнена с помощью флуоресцентной гибридизации in situ (FISH), что заключалось в нанесении одной клетки эмбриона на стадии расщепления (бластомера) на предметное стекло и гибридизацию ее ДНК с хромосомно-специфическими флуоресцентными зондами. Ограниченное количество исследованных хромосомных зондов также означало, что некоторые анеуплоидии остались непроверенными, что привело к переносу необнаруженных анеуплоидных эмбрионов.
В середине 2000-х годов стало ясно, что эти недостатки и диагностическая ненадежность в сочетании с негативными последствиями биопсии на стадии расщепления ставят под угрозу клинические исходы пациентов, для которых проводили ПГТ-А, что вызвало необходимость появления более безопасной, надежной и точной стратегии.
CCS комплексный хромосомный скрининг
>98% точность, которую показали все платформы CCS
Впоследствии разработка технологий комплексного хромосомного скрининга (CCS), включая сравнительную геномную гибридизацию (aCGH), массивы однонуклеотидных полиморфизмов (массивы SNP) и количественную полимеразную цепную реакцию (qPCR), обеспечила значительное улучшение клинического применения ПГТ-А.
При тестировании, проведенном на одной клетке из клеточных линий фибробластов с известным кариотипом, все платформы CCS показали точность выше 98% для детекции полных анеуплоидий.
Все платформы, которые способны анализировать все 23 пары хромосом, имеют сравнимую эффективность в выявлении анеуплоидии целой хромосомы, но отличаются друг от друга
aCGH, SNP и массивное параллельное секвенирование (MPS, NGS) требуют первого шага амплификации всего генома (WGA, полногеномной амплификации).
FISH и qPCR не требуют предварительного этапа амплификации.
NGS обеспечивает более высокую точность при оценке субхромосомных аномалий (например, сегментарных анеуплоидий) по сравнению с предыдущими методами CCS.
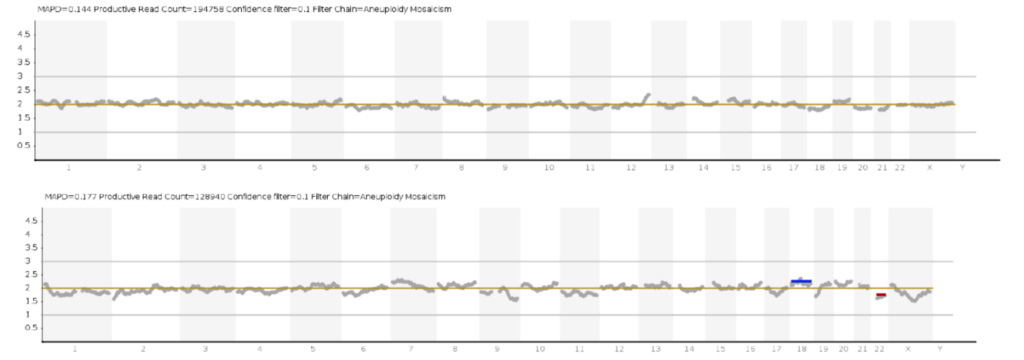
Кроме того, NGS используется для обнаружения хромосомного мозаицизма (когда две кариотипически разные популяции клеток сосуществуют в одном и том же эмбрионе).
Однако важно, что обнаружение мозаицизма низкого и высокого уровня (например, 20 и 80%, соответственно) должно интерпретироваться с особой осторожностью, так как при таких значениях уровня мозаицизма довольно трудно отличить биологические находки от технических особенностей секвенирования данного конкретного образца. Этот момент чрезвычайно важен, особенно для пациентов, с ограниченным количеством эмбрионов.
Кроме того, некоторые диагностические платформы могут также одновременно тестировать хромосомные аберрации и мутации одного гена.
Количественная ПЦР (qPCR) или ПЦР в реальном времени (ПЦР-РВ) — это полимеразная цепная реакция, которая может идентифицировать анеуплоидию целой хромосомы путем определения количества копий каждой анализируемой хромосомы.
Это достигается путем сравнения трех или четырех локус-специфических ампликонов вдоль каждой хромосомы с референсным геном, локализованным на той же хромосоме.
Этот анализ позволяет идентифицировать анеуплоидию для всех 23 пар хромосом за короткое время (4–12 ч; в зависимости от количества анализируемых образцов), и ввиду трудоемкости процесса при отсутствии его автоматизации, высока вероятность ошибки за счет человеческого фактора.
qPCR не может идентифицировать структурные хромосомные аберрации, но может идентифицировать триплоидию.
Поскольку qPCR не выявляет генотип, он не может идентифицировать однородительские дисомии. Для определения количества копий митохондрий может быть разработан отдельный план эксперимента.
Существует два основных типа микрочипов, доступных для генетического тестирования. Это массивы однонуклеотидных полиморфизмов и сравнительная геномная гибридизация.
Для обеих платформ микрочипов клетки трофэктодермы должны быть лизированы и амплифицированы с помощью некоторого типа протокола амплификации ДНК, который обеспечивает охват всего генома. Как и в случае любого генетического теста, качество диагностического результата начинается с качества образца амплифицированной ДНК.
SNP (однонуклеотидные полиморфизмы) — это пары одиночных нуклеотидов (A, T, C или G) в геномной ДНК, которые сильно варьируют в пределах данного вида. В контексте ПГТ-А оцениваемые SNP обычно находятся в некодирующих частях генома.
После WGA эмбриональная ДНК фрагментируется и гибридизуется с SNP микрочипом, который содержит зонды для более чем 300 000 различных SNP сайтов по всему геному.
После гибридизации выполняется этап удлинения цепи и окрашивания. A/T нуклеотиды на сайте SNP помечены с красным флуорохромом, а нуклеотиды G/C на сайте SNP помечены зеленым флуорохромом.
Измеряя интенсивность флуоресценции от красного к зеленому на каждом участке SNP в массиве, можно одновременно определить генотип более 300 000 SNP в каждом образце и сравнить полученные результаты с эталонным геномом карты человека.
Массивы полученных данных позволяют идентифицировать анеуплоидию всей хромосомы, а также могут идентифицировать приблизительно 250 общих структурных хромосомных аберраций по всему геному.
Однако существуют сотни других структурных аномалий хромосом, которые ниже разрешения 300 000 массивов SNP, используемых для ПГТ-А, которые могут играть важную роль при имплантации, выкидышах или рождении ребенка с серьезным генетическим синдромом. Поскольку предоставляется информация о генотипе, эти массивы SNP имеют ограниченную способность идентифицировать триплоидию, но могут идентифицировать однородительские дисомии.
SNP-микрочипы могут также идентифицировать мозаицизм, если проанализировано достаточное количество клеток трофэктодермы. Одним из ограничений SNP микрочипов, используемых для ПГТ-А, является неспособность их алгоритма идентифицировать число копий, когда муж и жена — кровные родственники.
Микрочипы CGH (aCGH) менее плотные, чем микрочипы SNP. Чипы aCGH, используемые для ПГТ-А, имеют приблизительно 4000 маркеров (которые прогоняются в дубле), расположенных по всему геному.
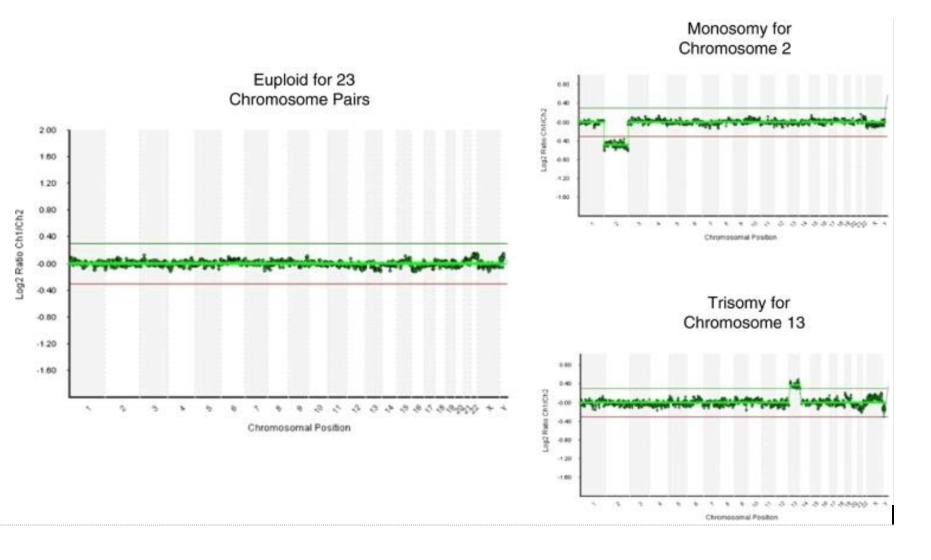
aCGH — это протокол выявления соотношений копийности клинического образца и референсного генома женского или мужского пола. Анализ может быть проведен в более короткие сроки по сравнению с SNP (за 12–15 часов).
Это является значительным преимуществом перед SNP микрочиповым исследованием, проведение которого требует около 30-40 часов. Генотипы, которые идентифицируются в SNP, в данном типе анализе не выявляются, а значит, aCGH не может различать кариотип 46, XX от 69,XXX или 46, XY от 69,XXY. Кроме того, aCGH не может выявлять однородительские дисомии. аCGH, используемый для ПГТ-А во всех коммерческих лабораториях, может идентифицировать только анеуплоидию всей хромосомы и не предназначен и не валидирован для идентификации структурных хромосомных аберраций. Даже если чипы aCGH валидированы для мозаичных образцов, то надо понимать, что способность выявлять мозаицизм в образцах трофэктодермы все-таки ограничена.
По некоторым данным процент ошибок при aCGH составляет приблизительно 15–30%*.
*Capalbo A, Treff NR, Cimadomo D, et al. Comparison of array comparative genomic hybridization and quantitative real-time PCR-based aneuploidy screening of blastocyst biopsies. Eur J Hum Genet: EJHG. 2015;23:901–6. doi: 10.1038/ejhg.2014.222
В других валидационных исследованиях, при сравнении NGS и CGH, уровень конкордантности достигает 99%**.
**данные Paul R. Brezina, на 400 образцах
Секвенирование следующего поколения (NGS) — это технология, которая требует очень «аккуратной» амплификации ДНК, чтобы снизить вероятность возникновения артефактов во время процесса амплификации.
Впрочем, после амплификации ДНК в большинстве случаев артефакты могут быть идентифицированы и удалены с помощью биоинформатического анализа.
В настоящее время для ПГТ-А используются две основные платформы. Это MiSeq от Illumina и S5 от Thermo-Fisher Scientific. S5 является усовершенственной версией его предшественника PGM.
После амплификации ДНК приблизительно 50 нг каждого образца ДНК ферментативно расщепляется на миллионы фрагментов и объединяется для подготовки библиотеки. Подготовка библиотеки — это тот процесс, в котором все фрагменты ДНК «сшиваются» с адаптером и уникальным идентификатором — баркодом.
Хорошо приготовленная библиотека создает репрезентативное объективное представление нуклеиновых кислот и имеет решающее значение для точного молекулярного анализа.
После подготовки библиотеки либо выполняется этап мостиковой ПЦР. Для MiSeq происходит секвенирование путем синтеза на основе детекции флуоресценции, которая регистрируется с помощью оптической камеры.
Платформа позволяет одновременно анализировать до 24 образцов.
После подготовки библиотеки либо выполняется этап эмульсионной ПЦР. S5 использует эффект чувствительного к ионам поля, при котором детектируется сигнал по мере высвобождения иона водорода, что происходит каждый раз, когда ДНК-полимеразой во время секвенирования встраивается нуклеотидтрифосфат.
Высвобождение протона вызывает небольшое смещение pH, которое регистрируется с помощью чувствительного датчика.
Платформа масштабируема и позволяет одновременно анализировать 16, 24 или 96 образцов.
И MiSeq, и S5 секвенируют весь геном и данные секвенирования сравнивают с референсным геномом человека.
Обе платформы позволяют провести анализ (от амплификации ДНК до формирования окончательного отчета) через 12-16 часов.
После анализа последовательности, возникают существенные различия между анализом данных MiSeq и анализом данных S5.
ДНК MiSeq проходит первый раунд показателей обеспечения качества, за которым следует анализ с использованием программного обеспечения BlueFuse.
MiSeqот Illumina
Анализ на S5 проходит первый раунд показателей обеспечения качества с использованием Torrent Browser, после чего проводится детальный анализ с помощью программного обеспечения Ion Reporter.
S5 и PGM от Thermo-Fisher Scientific
Существуют различия при анализе данных двух платформ. Главным образом, хочется отметить то, что биоинформатический алгоритм анализа данных в Ion Reporter является гибким, настраиваемым в зависимости от различных задач и доступным для подробного изучения. Подробную информацию можно найти в брошюре:
1. Низкое качество образцов и появление артефактов амплификации.
Плохое качество образца (например, деградированная ДНК) и проблемы на этапе амплификации ДНК приводят к увеличению общего шума и пиков.
2. На качество полногеномной амплификации может повлиять целый ряд факторов:
Эти факторы, как правило, проявляются в образцах с биопсией одной клетки, чем в образцах с биопсией трофоэктодермы, где доступно большее количество исходного материала.
3. Недостаточное количество прочтений (ридов) также может привести к появлению шумного профиля и присвоению ложного числа копий.
4. Трудоемкость определенных этапов протокола некоторых производителей (например, отмывка каждого образца на магнитных частицах может привести к пересушиванию и ухудшению качества образца).
Очень важно при анализе множества образцов, чтобы концентрации ДНК образцов в объединенной библиотеке были сбалансированы.
Амплификация вызывает «перекос» в сторону тех или иных фрагментов — таким образом возникает проблема неравномерного покрытия. Решение:
Дуплицированные прочтения (риды) могут перепредставлять артефакт амплификации. Решение:
При обработке результатов ПГТ-А специалисты лаборатории учитывают необходимость детекции мегких сегментарных нарушений.
При выявлении мозаицизма (для полных хромосом или сегметарных нарушений), специалисты дают четкие рекомендации относительно возможности рассмторения конкретного эмбриона для переноса с информированного согласия пациента.
При таком сценарии пациенты должны консультироваться с врачом о последствиях такого переноса.
Отдельное и особое внимание требуется при рассмотрении возможности переноса нелетальных анеуплоидий (по половым хромосомам 47,XXX, 47XXY, 47XYY).
Собственное IT решение «Личный кабинет» — еще одно преимущество сотрудничества с First Genetics.
Для врачей клиник-партнеров предоставляется доступ в личный кабинет, который позволяет отслеживать каждый этап исследования.
Решение разработано при помощи:
Ознакомится с функционалом решения можно в видео инструкции.
Метод NGS позволяет анализировать все хромосомы эмбриона, а также выявлять мозаицизм и несбалансированные хромосомные перестройки
Многолетний опыт работы в области генетики, лабораторной диагностики и биоинформатики
Все данные строго конфиденциальны и не могут быть переданы третьим лицам
Возможность проведения онлайн консультации по результатам исследования
Контроль качества на каждом этапе исследования
Доставка биоматериала по всей России